មានតែថ្នាំថ្មីចំនួន 42 ប៉ុណ្ណោះក្នុងចំណោម 460 ប្រភេទដែលត្រូវបានផ្សព្វផ្សាយទូទាំងពិភពលោកដែលមាននៅក្នុងប្រទេសវៀតណាម ដោយសារតែនីតិវិធីនៃការផ្តល់អាជ្ញាប័ណ្ណយូរ និងពេលវេលាដែលប៉ះពាល់ដល់អ្នកជំងឺ។
កាលពីថ្ងៃទី 21 ខែមករា តំណាងក្រសួងសុខាភិបាលបាននិយាយថា តម្លៃឱសថទូទៅនៅប្រទេសវៀតណាមមានកម្រិតទាបបើធៀបនឹងប្រទេសដទៃទៀតក្នុងតំបន់អាស៊ាន (សម្រាប់ក្រុមព្យាបាលសំខាន់ៗភាគច្រើន)។ ខណៈដែលអត្រានៃការប្រើប្រាស់ថ្នាំទូទៅក្នុងគ្រឹះស្ថានពេទ្យវៀតណាមមានចំនួន ១១% បើធៀបនឹងជាង ២៧% នៅក្នុងប្រទេសអាស៊ី ប៉ាស៊ីហ្វិក ។
ទិន្នន័យពីអង្គការស្រាវជ្រាវឱសថ IQVIA MIDAS បានធ្វើបច្ចុប្បន្នភាពក្នុងត្រីមាសទីមួយនៃឆ្នាំ 2022 ក៏បង្ហាញផងដែរថាអ្នកជំងឺវៀតណាមមានការលំបាកក្នុងការទទួលបានថ្នាំថ្មីបើប្រៀបធៀបទៅនឹងប្រទេសដទៃទៀត។ ជាក់ស្តែង មានតែ 9% ប៉ុណ្ណោះ (ស្មើនឹងថ្នាំថ្មីចំនួន 42) ដែលមាននៅក្នុងប្រទេសវៀតណាម ក្នុងចំណោមថ្នាំសរុបចំនួន 460 ដែលបានណែនាំទៅកាន់ទីផ្សារពិភពលោកក្នុងរយៈពេល 10 ឆ្នាំចុងក្រោយនេះ (ចាប់ពីឆ្នាំ 2012 ដល់ចុងឆ្នាំ 2021)។
ភាពលំបាកក្នុងការទទួលបានថ្នាំថ្មីកំពុងបង្កើតបន្ទុកធ្ងន់ដល់អ្នកជំងឺ។ ឧទាហរណ៍ ប្រហែល 25% នៃប្រជាជនវៀតណាមទទួលរងពីជំងឺសរសៃឈាមបេះដូង និងលើសឈាម។ អ្នកជំងឺជាង 350,000 នាក់កំពុងរស់នៅជាមួយជំងឺមហារីក ប៉ុន្តែមនុស្សជាច្រើនបានបោះបង់ចោលដោយសារតែការលំបាកក្នុងការទទួលបានថ្នាំថ្មី។ យោងតាមលោកវេជ្ជបណ្ឌិត Vu Ha Thanh អនុប្រធាននាយកដ្ឋានវេជ្ជសាស្ត្រផ្ទៃក្នុង 2 មន្ទីរពេទ្យ K បានឱ្យដឹងថា បច្ចុប្បន្ននេះមានតែថ្នាំ immunotherapy បីប៉ុណ្ណោះក្នុងការព្យាបាលជំងឺមហារីកដែលមានអាជ្ញាប័ណ្ណ ពីក្រសួងសុខាភិបាល ខណៈដែលពិភពលោកបានទទួលស្គាល់ការព្យាបាលថ្មីៗជាច្រើន។ ឱសថទាំងនេះមិនទាន់មានការធានារ៉ាប់រងសុខភាពនៅឡើយ ដែលបណ្តាលឲ្យអ្នកជំងឺជាច្រើនបោះបង់ការព្យាបាល ដោយសារខ្វះហិរញ្ញវត្ថុ។
ហេតុផលសម្រាប់ស្ថានភាពនេះគឺថាល្បឿននៃការទទួលបានថ្នាំថ្មីគឺពឹងផ្អែកយ៉ាងធំទៅលើពេលវេលាដែលវាត្រូវការសម្រាប់ឱសថដើម្បីទទួលបានវិញ្ញាបនបត្រនៃការចុះបញ្ជីចរាចរ។ យោងតាមបទប្បញ្ញត្តិនៃច្បាប់ឱសថសាស្ត្រឆ្នាំ 2016 ថ្នាំត្រូវតែចុះបញ្ជីជាមួយទីភ្នាក់ងារគ្រប់គ្រងរដ្ឋ (នាយកដ្ឋានរដ្ឋបាលឱសថ ក្រសួងសុខាភិបាល ) មុនពេលចរាចរនៅលើទីផ្សារវៀតណាម រយៈពេលអតិបរមាសម្រាប់ការផ្តល់វិញ្ញាបនបត្រចុះបញ្ជីការ (GĐKLH) គឺ 12 ខែ។
ទោះជាយ៉ាងណាក៏ដោយ តាមការពិត ជារឿយៗវាត្រូវចំណាយពេល 4-5 ឆ្នាំសម្រាប់ឱសថថ្មីដើម្បីទទួលបាន GDC ពីព្រោះដំណើរការនេះនៅតែមានភាពខ្វះខាតជាច្រើននៅក្នុងបទប្បញ្ញត្តិរដ្ឋបាល ដែលបណ្តាលឱ្យមានការលំបាកសម្រាប់ទាំងភ្នាក់ងារគ្រប់គ្រង និងអាជីវកម្មដោយសារធនធានមានកំណត់។
ក្នុងរយៈពេលថ្មីៗនេះ ការខ្វះខាតគ្រឿងញៀនបាននិងកំពុងកើតឡើងជាបន្តបន្ទាប់ ដែលមួយផ្នែកដោយសារនីតិវិធីនៃការបន្តលិខិតបញ្ជាក់ការចុះឈ្មោះរៀងរាល់ 5 ឆ្នាំម្តង បន្ទាប់ពីត្រូវបានចេញសារជាថ្មី។ ថ្នាំដែលផុតកំណត់មិនត្រូវបានអនុញ្ញាតឱ្យប្រើនៅក្នុងកន្លែងពិនិត្យសុខភាព និងកន្លែងព្យាបាលទេ រហូតដល់ភ្នាក់ងារគ្រប់គ្រងបន្តសុពលភាព។
ដើម្បីដោះស្រាយបញ្ហាបន្ទាន់ រដ្ឋាភិបាលបានចេញដំណោះស្រាយលេខ 80 នៅដើមឆ្នាំ 2023 ដោយពន្យារសុពលភាពជាបណ្ដោះអាសន្ននៃឱសថ GKDLH ដែលផុតកំណត់រហូតដល់ចុងឆ្នាំ 2024 ។ ការពន្យារនេះមិនប៉ះពាល់ដល់គុណភាព សុវត្ថិភាព និងប្រសិទ្ធភាពនៃឱសថនោះទេ ព្រោះថ្នាំទាំងនេះត្រូវបានចុះបញ្ជីសម្រាប់ចរាចរជាច្រើនឆ្នាំនៅក្នុងប្រទេសវៀតណាម និងប្រទេសជាច្រើនជុំវិញពិភពលោក។
លោក Le Viet Dung នាយករងរដ្ឋបាលឱសថនៃប្រទេសវៀតណាម ក្រសួងសុខាភិបាល បានឲ្យដឹងថា ក្នុងរយៈពេល១០ខែដើមឆ្នាំ២០២៣ នាយកដ្ឋានមានសេចក្តីប្រកាសចំនួន៩ ដើម្បីពន្យារសុពលភាពវិញ្ញាបនបត្រចុះបញ្ជីឱសថ និងធាតុផ្សំឱសថ រហូតដល់ថ្ងៃទី៣១ ខែធ្នូ ឆ្នាំ២០២៤។

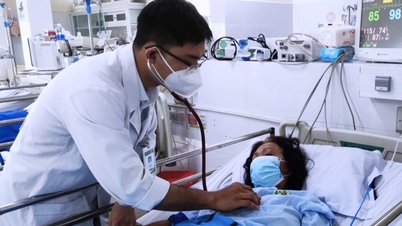
បុគ្គលិកពេទ្យនៅឱសថស្ថានជំងឺត្រូពិចទីក្រុងហូជីមិញ ផ្តល់ថ្នាំដល់អ្នកជំងឺ។ រូបថត៖ Quynh Tran
គម្រោងច្បាប់ឱសថស្ថានដែលត្រូវបានកែសម្រួលកំពុងត្រូវបានបញ្ចប់ ដោយផ្តោតលើការអភិវឌ្ឍន៍ឧស្សាហកម្មឱសថ បង្កើតច្រកផ្លូវច្បាប់ដើម្បីផ្តល់អាទិភាពដល់ការស្រាវជ្រាវ ការផ្ទេរបច្ចេកវិទ្យា និងការផលិតឱសថប្រកបដោយភាពច្នៃប្រឌិត និងឱសថបច្ចេកវិទ្យាខ្ពស់ ជួយអ្នកជំងឺឱ្យងាយស្រួលប្រើប្រាស់ថ្នាំថ្មីៗ។ នេះគឺជាក្រុមគោលនយោបាយមួយក្នុងចំណោមក្រុមគោលនយោបាយទាំង 5 ដែលផ្តោតលើគម្រោងច្បាប់ឱសថដែលបានកែសម្រួលនេះ ក្នុងគោលបំណងលើកកម្ពស់ការអភិវឌ្ឍឧស្សាហកម្មឱសថ ជួយវេជ្ជបណ្ឌិត និងអ្នកជំងឺបង្កើនលទ្ធភាពប្រើប្រាស់ និងជម្រើសនៃឱសថព្យាបាល។
ជាពិសេស ក្រសួងសុខាភិបាលបានស្នើឱ្យសម្រួលឯកសារ និងនីតិវិធីសម្រាប់ពង្រីក ផ្លាស់ប្តូរ និងបន្ថែម GĐKLH និងគ្រឿងផ្សំឱសថ។ គ្រប់គ្រងករណីនៃការពង្រីក ផ្លាស់ប្តូរ និងបំពេញបន្ថែម GĐKLH ដោយមិនឆ្លងកាត់ក្រុមប្រឹក្សាប្រឹក្សាសម្រាប់ការចុះបញ្ជីឱសថ។ ក្នុងពេលជាមួយគ្នានេះ កាត់បន្ថយពេលវេលាសម្រាប់ការបន្ត GĐKLH (កាត់បន្ថយពី 3 ខែទៅ 1 ខែសម្រាប់ករណីនៃការពន្យាពេលមិនឆ្លងកាត់ក្រុមប្រឹក្សា)។
ក្រសួងសុខាភិបាលក៏បានស្នើឱ្យអនុញ្ញាតឱ្យមានការជំនួសវិញ្ញាបនបត្រផលិតផលឱសថ។ ការលើកលែងការបញ្ជូនឯកសារព្យាបាលសម្រាប់ថ្នាំដែលផលិតក្នុងស្រុកថ្មី ដើម្បីបំពេញតម្រូវការបន្ទាន់។ និងយន្តការយោង និងការទទួលស្គាល់ក្នុងការចុះបញ្ជីឱសថ ដើម្បីជួយមនុស្សឱ្យទទួលបានថ្នាំទំនើប និងថ្មីយ៉ាងឆាប់រហ័ស។
សេចក្តីព្រាងច្បាប់នេះកំពុងត្រូវបានវាយតម្លៃដោយក្រសួងយុត្តិធម៌។ គេរំពឹងថា សេចក្តីព្រាងច្បាប់នេះ នឹងត្រូវបានរដ្ឋសភាពិចារណាក្នុងសម័យប្រជុំលើកទី៧ (ខែឧសភា ឆ្នាំ២០២៤) និងអនុម័តនៅសម័យប្រជុំលើកទី៨ (ខែតុលា ឆ្នាំ២០២៤)។
ឡេង៉ា
ប្រភពតំណ




![[រូបថត] ស្ពាន Binh Trieu 1 ត្រូវបានសាងសង់រួចរាល់ កម្ពស់ 1.1m ហើយនឹងបើកឱ្យធ្វើចរាចរនៅចុងខែវិច្ឆិកា។](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/2/a6549e2a3b5848a1ba76a1ded6141fae)















![[វីដេអូ] ក្រសួងសុខាភិបាលចេញឯកសារដើម្បីកែតម្រូវការងារពិនិត្យ និងព្យាបាលជំងឺ](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/10/2/54913f30a9934e18bcbb246c2c85f11d)















































































Kommentar (0)