Derzeit dienen klinische Studien in Vietnam hauptsächlich der Entwicklung neuer Produkte, beispielsweise von Medikamenten, Impfstoffen, medizinischen Geräten, neuen Behandlungstechniken usw. In den letzten Jahren gab es insbesondere Studien zur Zell- und Gentherapie.
Klinische Studien müssen vor der Durchführung genehmigt und genau evaluiert werden, da der Testprozess sowie neue Produkte und Techniken Risiken für die an der Forschung teilnehmenden Freiwilligen bergen können.
Tatsächlich gab es im Laufe der Jahre jedoch Studien, die von anderen Ministerien und Sektoren als dem Gesundheitsministerium genehmigt wurden, um Forschung an Menschen durchzuführen, die jedoch nicht vom Rat für Ethik in der biomedizinischen Forschung genehmigt wurden.
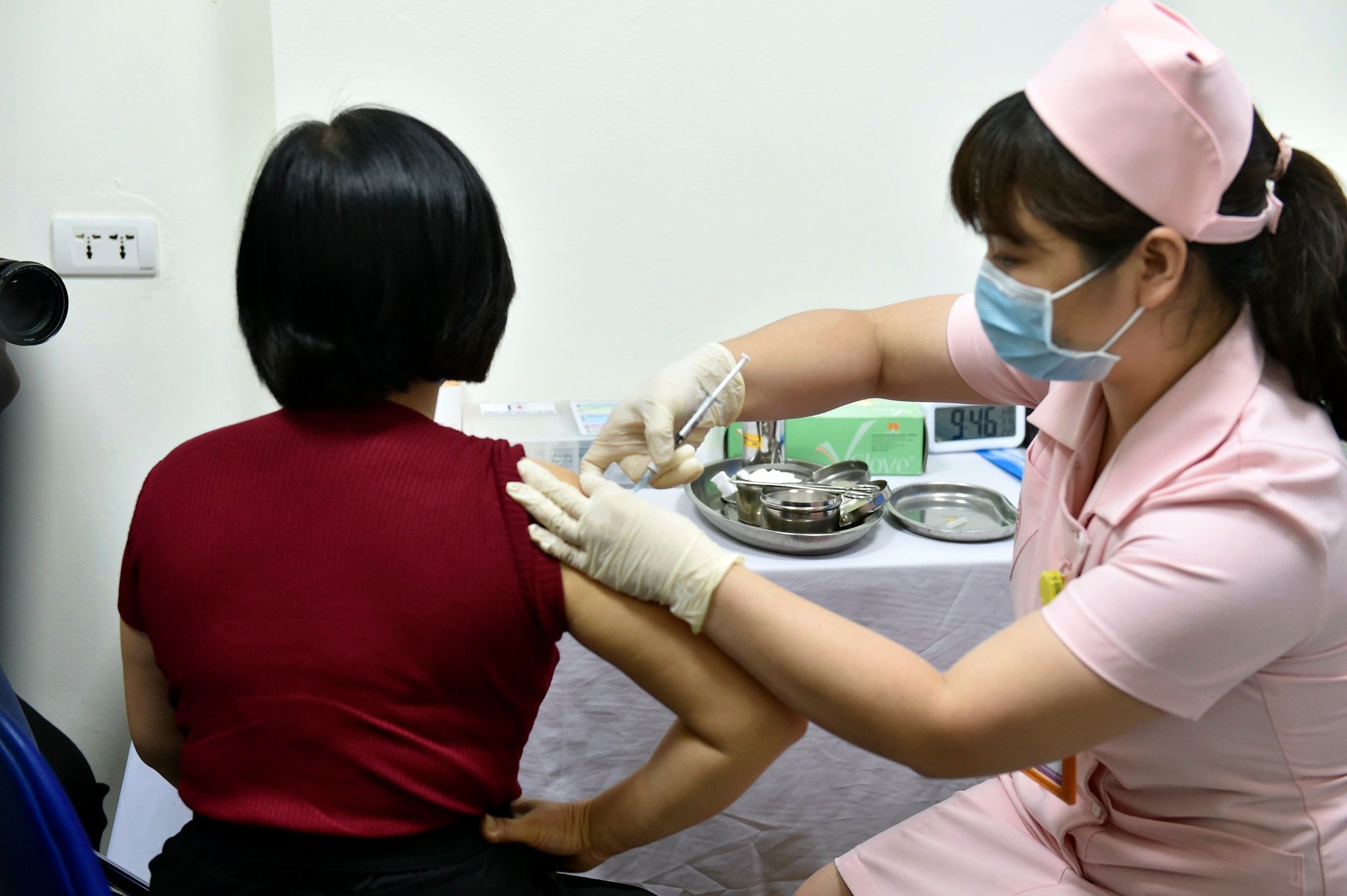
Experimentelle Injektion des Covid-19-Impfstoffs Covivac an der Medizinischen Universität Hanoi , März 2021
Das Gesundheitsministerium bittet um Stellungnahmen zu einem Rundschreibenentwurf zur Regelung der Verwaltung wissenschaftlicher und technologischer Aufgaben in der Verantwortung des Gesundheitsministeriums. Der Entwurf sieht vor, dass Forschungsthemen, die aus nicht-budgetären Quellen finanziert und von anderen Ministerien und Sektoren verwaltet werden, aber Forschung am Menschen beinhalten, nur nach Genehmigung durch den Ethikrat für biomedizinische Forschung und nach Zustimmung des Gesundheitsministeriums durchgeführt werden dürfen. Gleichzeitig betont und fördert der Entwurf die Rolle von Basisgremien in den einzelnen Einheiten bei der Genehmigung von Forschungsvorhaben, verkürzt die Genehmigungszeit im Gesundheitsministerium und sichert den Forschungsfortschritt.
In Vietnam finden jährlich etwa 100 klinische Studien statt, was dem Land den Zugang zu neuen Technologien, Produkten und Methoden in der Behandlung und Gesundheitsfürsorge erleichtert, insbesondere bei schwierigen Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen usw. Wenn neue Produkte und Techniken zugelassen werden, ist Vietnam auch der Ort, an dem man frühzeitig darauf zugreifen kann, darunter Medikamente, Impfstoffe usw. Vor der offiziellen Zulassung kann der Prozess klinischer Studien jedoch Gesundheits- und Lebensrisiken für die Probanden bergen, sodass er während der Durchführung streng genehmigt und überwacht werden muss.
Gemäß den geltenden Vorschriften ist das Gesundheitsministerium für die Verwaltung, Anleitung und Organisation der Durchführung biomedizinischer Forschung am Menschen verantwortlich. Vor der Durchführung wissenschaftlicher und technologischer Aufgaben im Zusammenhang mit der biomedizinischen Forschung am Menschen muss die zuständige Organisation die Genehmigung des Ethikrats für biomedizinische Forschung einholen (wie im Rundschreiben Nr. 04/2020/TT-BYT vorgeschrieben).
[Anzeige_2]
Quellenlink




![[Foto] Feierliche Eröffnung des 1. Parteitags der Regierungspartei](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/13/1760337945186_ndo_br_img-0787-jpg.webp)
































![[Foto] Generalsekretär To Lam nimmt an der Eröffnung des 1. Kongresses der Regierungspartei teil](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/13/1760321055249_ndo_br_cover-9284-jpg.webp)







































































Kommentar (0)